猪圆环病毒2型(PCV2)4种基因型(PCV2a、PCV2b、PCV2d和PCV2e)在实验感染猪中的致病性比较
Hyejean CHO,Taehwan OH,Jeongmin SUH,Chanhee CHAE,
(韩国首尔国立大学兽医学院兽医病理学系)
摘要:本研究的目的是比较猪圆环病毒2型(porcine circovirus type 2,PCV2)的四种基因型(PCV2a、PCV2b、PCV2d和PCV2e)对猪的毒力。在42日龄时对试验猪接种PCV2四种基因型中的一种,在63日龄时对免疫猪进行剖解。通过比较临床结果、抗体滴度、血液和淋巴结中的PCV2载量,以及淋巴结病变的严重程度,对PCV2基因型组进行评估。各基因型组试验猪之间没有统计学意义上的显著差异。在试验猪血液和淋巴结中的PCV2载量上,PCV2a组、PCV2b组或PCV2d组试验猪明显更高于PCV2e组试验猪的(P<0.05)。该研究表明,基于血液和淋巴中的PCV2的载量,在毒力上,PCV2a、PCV2b和PCV2d比PCV2e更强。
关键词:猪圆环病毒2a型;猪圆环病毒2b型;猪圆环病毒2d型;猪圆环病毒2e型;毒力

猪圆环病毒2型(porcine circovirus type 2,PCV2)是现存最小的无包膜环状单链DNA病毒,属于圆环病毒属圆环病毒科[19]。PCV2最初于20世纪90年代在加拿大被发现,是全球养猪行业中经济影响最重要的病毒性病原体之一[3]。PCV2与猪的多种临床表现有关,统称为猪圆环病毒相关疾病(porcine circovirus associated disease,PCVAD),包括断奶后多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)、猪皮炎和肾病综合征(porcine dermatitis and nephropathy syndrome,PDNS)、猪呼吸系统综合征(porcine respiratory disease complex,PRDC)、繁殖障碍和肠炎[4]。
迄今为止,根据第一次鉴定的顺序,PCV2至少有8种不同的基因型(PCV2a至PCV2h),分别在病毒名后冠以小写字母(a、b、c、d、e等)对基因型进行命名[9]。其中,PCV2a、PCV2b和PCV2d是目前流行于全球猪群中的三种主要基因型。同样,相同的PCV2基因型(PCV2a、PCV2b和PCV2d)在韩国猪群中定期流行(active circulation)[22]。2015—2016年,美国和墨西哥首次报道了PCV2e[6,13],但该基因型首次从猪身上分离出来的时间为2020年[23]。之前的比较研究评估了相同的临床参数,但排除了PCV2e,并得出结论,PCV2a、PCV2b和PCV2d都产生了相似的毒力[5]。本研究的目的是通过评估实验感染猪的临床结果、抗体滴度、血液和淋巴结中PCV2载量以及淋巴病变的严重程度,首次比较PCV2四种基因型(PCV2a、PCV2b、PCV2d和PCV2e)的毒力。
从一个无猪繁殖与呼吸综合征病毒(reproductive and respiratory syndrome virus,PRRSV)的商品猪场购买了30头40日龄普通仔猪,这些仔猪由无PCV2疫苗接种史的母猪所产,临床健康,吮吸过初乳。该猪场还根据血清学,以及长期的临床和屠宰史进行了无猪肺炎支原体检测。使用市售ELISA试剂盒(PRRSV:HerdChek PRRS X3 Ab测试,IDEXX Laboratories股份有限公司,Westbrook,ME,USA;PCV2:INgezim CIRCO IgG,Ingenasa,Madrid,Spain;猪肺炎分枝杆菌:猪流感分枝杆菌Ab测试,IDEXX Laberatories股份有限公司,Westbrok,ME,USA.)对试验猪进行血清学评估,并检测出试验猪为PRRSV、PCV2和猪肺炎分枝菌血清阴性。抵达试验猪场后,通过实时聚合酶链式反应(PCR)检测,确认它们的PCV2(PCV2a、PCV2b、PCV2d和PCV2e)和PRRSV病毒血症以及猪肺炎支原体喉部脱落均为阴性。
本研究使用Excel(美国华盛顿州雷德蒙德市微软公司)的随机数生成器函数,将试验猪分为5组(每组6头)(表1)。每组的试验猪被随机分配到五个独立的猪栏中。在接种后的0 d(days post inoculation,dpi;42日龄),PCV2a、PCV2b、PCV2d和PCV2e组的试验猪用3 mL各自的攻击毒株鼻内接种;PCV2a组接受PCV2a SNUVR100032毒株(GenBank编号KF871067),PCV2b组接受PCV2b SNUVR202155毒株(GenBank编号MZ440696),PCV2d组接受PCV2d SNUVR20003毒株(GenBank编号MZ440695),PCV2e组接受PCV2e SNUVR199707毒株(GenBank编号MN967003)。PCV2e分离自82日龄猪的腹股沟浅淋巴结,该猪已经出现生长迟缓[23]。每个接种物在第5代无PCV的PK15细胞系中含有1.2×10 50%的组织培养感染剂量(tissue culture infective dose,TCID50/mL)。阴性对照组试验猪鼻内接种6 mL(3 mL/鼻孔)未感染的细胞培养上清液。
在0、7、14和21 dpi,通过穿刺颈静脉从每头试验猪上采集血液样本。通过静脉注射戊巴比妥钠对试验猪进行镇静,然后按照Beaver等[1]的方法,在21 dpi通过电击实施安乐死。尸检时从采集每头试验猪的组织样本。所有实验方案在研究前均已获得首尔国立大学机构动物护理和使用委员会(SNU-210226-2)的批准。
每天监测试验猪的临床症状,每周使用0(正常)至6的评分系统进行评分(严重呼吸困难和腹式呼吸)[12]。所有参与这些试验过程的观察者都对所用挑战病毒的类型一无所知。
在42(0 dpi)和63(21 dpi)日龄时对试验猪进行称重。在42~63日龄,分析平均日增重(ADWG;单位为g/头/d)。ADWG的计算方法是初始重和终末重之差除以试验持续时间。在计算时,死亡或被淘汰试验猪的数量也计入其中。
使用商用试剂盒(QIAamp DNA Mini kit,QIAGEN,Valencia,CA,USA)从PCV2血清样本中提取DNA。通过实时PCR定量PCV2a、PCV2b、PCV2d和PCV2e的基因组DNA拷贝数[10,14,21,24]。
还检测了血清样本中针对PCV2的抗体(INgezim CIRCO IgG,Ingenasa,西班牙马德里)。根据制造商的说明,如果光密度(optical density,OD)大于0.3,则认为所检测样本的PCV2抗体呈阳性。
为了对腹股沟浅淋巴结的组织病理学变化进行形态计量分析,需要检查该淋巴结的三个切片[16]。评估淋巴结是否存在淋巴耗竭和炎症,并给出0~5分的评分(0=正常;1=轻度淋巴耗竭;2=轻度至中度淋巴耗竭和组织细胞置换;3=中度弥漫性淋巴衰竭和组织细胞替代;4=中度至重度淋巴耗竭和组织细胞置换;5=严重淋巴耗竭和组织细胞替代)结果。
按照Kim等[15]推荐的方法,对淋巴组织进行免疫组织化学(Immunohistochemistry,IHC)和IHC的形态计量分析。使用NIH Image J 1.45s程序对阳性信号进行定量(http://imagej.nih.gov/ij/download.html)。对于每张淋巴结组织切片,随机选择10个区域,并计算每单位面积(0.25 mm2)的阳性细胞数量,还计算平均值[15]。
在统计分析之前,对实时PCR数据进行对数转换,以减少方差和正偏斜度。使用Shapiro-Wilk检验对数据进行正态分布检验。用单因素方差分析(ANOVA)检查5个试验组在每个时间点上是否存在统计学意义上的显著差异。当单因素方差分析的检验结果显示具有统计学意义时,进行事后检验(post-hoctest),与Tukey的校正进行成对比较。如果不符合正态性假设,则进行Kruskal-Wallis检验。当Kruskal-Wallis检验的结果显示具有统计学意义时,进行Mann-Whitney检验以比较各组之间的差异。用P<0.05表示差异显著的。
所有接种了PCV2四种基因型中任何一种的试验猪在临床上都保持正常,这意味着它们没有PCVAD相关的临床症状,如厌食、黄疸、呼吸困难、嗜睡、抑郁和发烧。PCV2感染试验猪和阴性对照试验猪的临床症状没有统计学意义上的显著差异。在实验开始时(42日龄),所有5个处理组(4个感染组和1个对照组)试验猪的平均体重没有统计学意义上的显著差异。5个处理组的试验猪在42~63日龄时的平均日增重没有统计学意义上的差异(表1)。
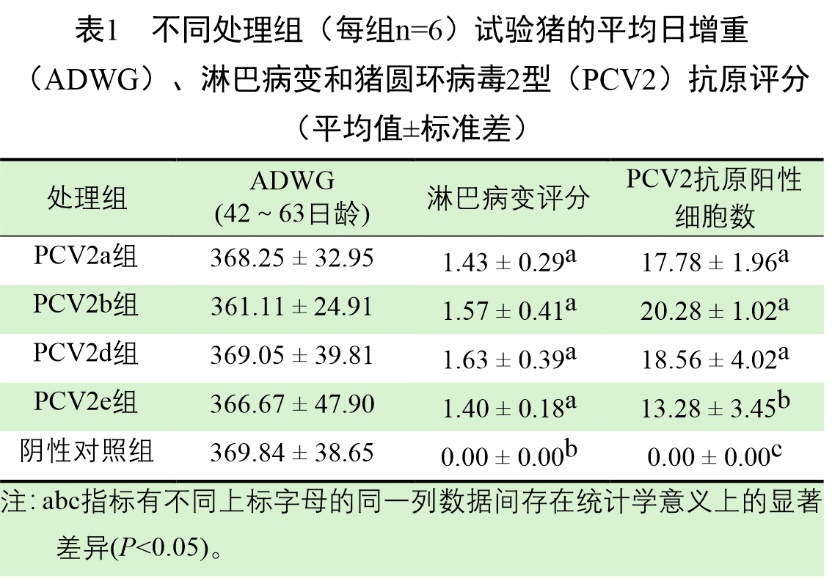
接种前,从5个处理组试验猪上收集的所有血清样本均检测为PCV2抗体阴性。在测量的任何时间点,接种PCV2a、PCV2b、PCV2d和PCV2e的试验猪在PCV2-ELISA抗体滴度上没有统计学意义上的差异。阴性对照组试验试验猪在每个时间点都没有检测到PCV2抗体(图1)。
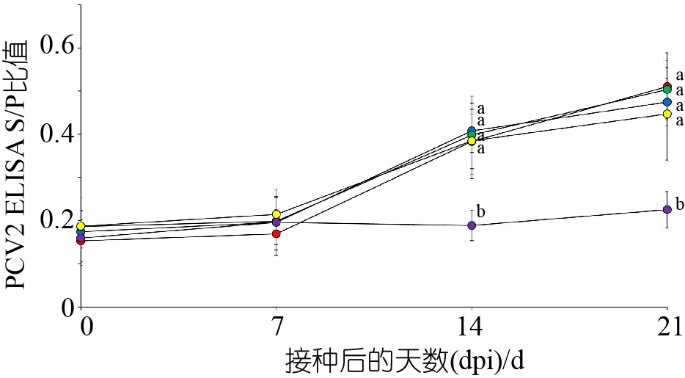
图1 接种PCV2a(红圈)、PCV2b(蓝圈)、PCV2d(绿圈)和PCV2e(黄圈)以及阴性对照(紫圈)组的试验猪血清中PCV2特异性ELISA抗体水平
注:变化以标准偏差表示。ab表示标有不同上标字母的处理组之间存在显著差异(P<0.05)。
接种前,从5个处理组试验猪上收集的所有血清样本均检测为PCV2a、PCV2b、PCV2d和PCV2e阴性。与接种PCV2e的试验猪相比,接种PCV2a、PCV2b和PCV2d的试验猪在21 dpi时的PCV2基因组拷贝数显著增多(P<0.05)。在研究期间,阴性对照组试验猪中未检测到PCV2基因组拷贝(图2)。在感染PCV2a、PCV2b、PCV2d(图3A)、PCV2e(图3B)的试验猪上观察到淋巴轻度耗竭。接种PCV2a、PCV2b、PCV2d和PCV2e的试验猪在21 dpi时的淋巴病变评分没有统计学意义上的差异。
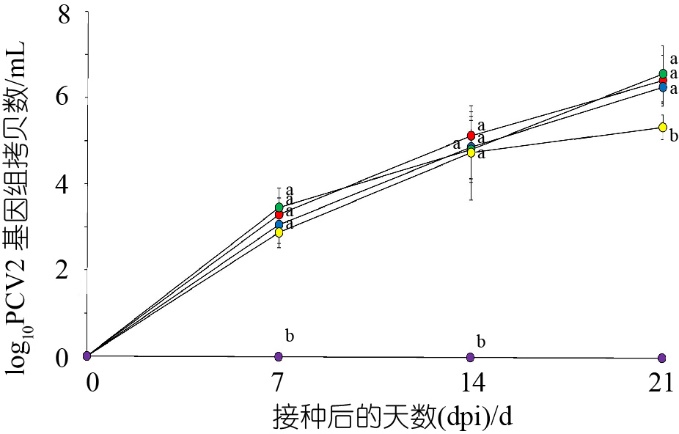
图2 接种PCV2a(红圈)、PCV2b(蓝圈)、PCV2d(绿圈)和PCV2e(黄圈)以及阴性对照(紫圈)组的试验猪血清中PCV2 DNA基因组拷贝数的平均值
注:变化以标准偏差表示。不同上标(a、b和c)表示5个处理组之间存在显著差异(P<0.05)。
所有感染PCV2四种基因型之一的试验猪都进行了PCV2抗原的免疫标记。PCV2抗原主要在滤泡巨噬细胞中观察到。接种PCV2a、PCV2b和PCV2d的试验猪(图3C)淋巴结中每单位面积(0.25 mm2)的PCV2抗原阳性细胞数量明显高于接种PCV2e的试验猪的(见图3D)(P<0.05)。在阴性对照组试验猪的任何淋巴结样本中均未检测到PCV2抗原(表1)。
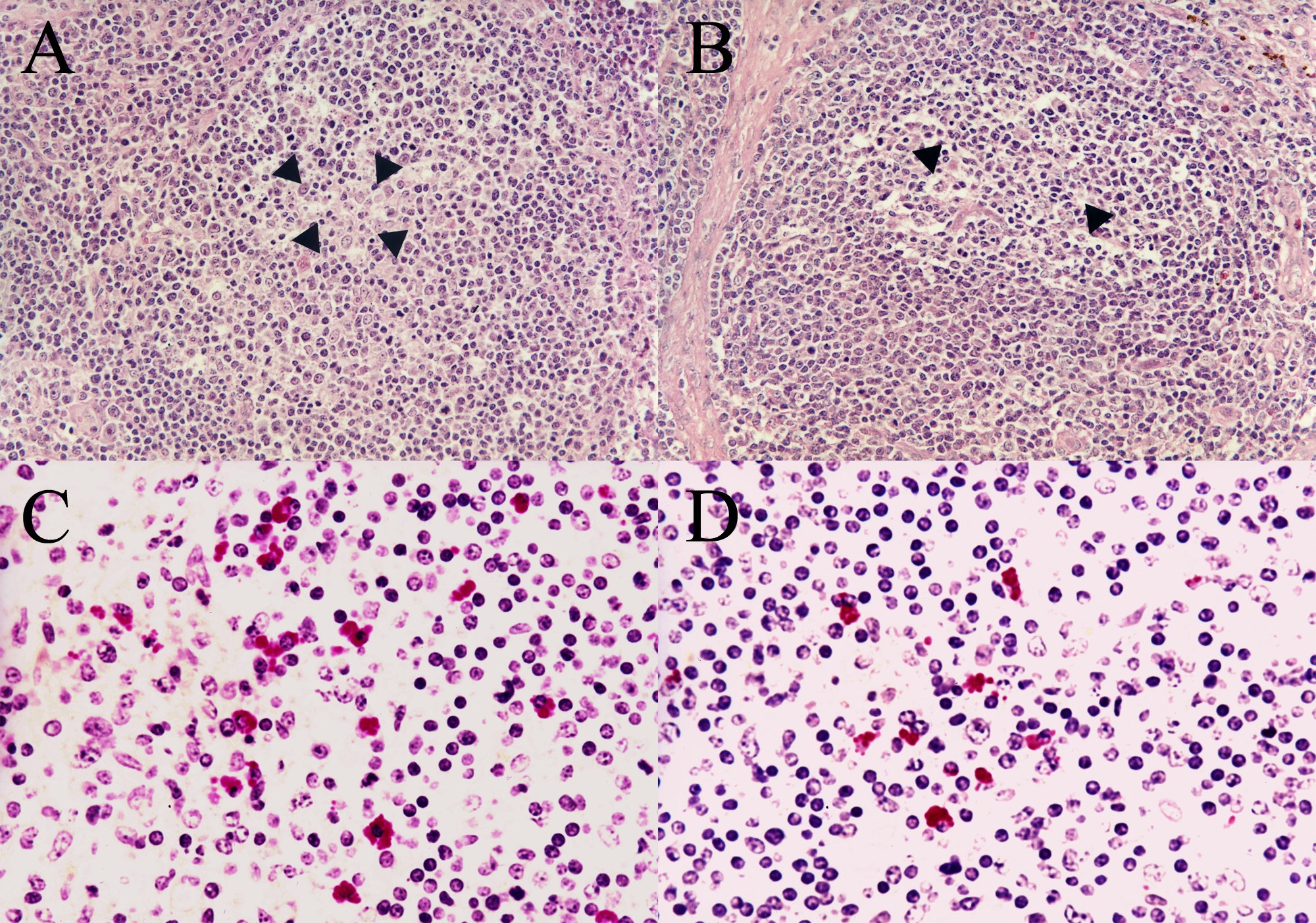
图3 猪淋巴结的组织病理学和免疫组织化学
注:(A)与PCV2d无关的猪淋巴结组织中淋巴轻度耗竭(箭头所指是处);HE,×200。(B)接种PCV2e的猪淋巴结组织中淋巴轻度耗竭(箭头所指是处);HE,×200。(C)接种PCV2d的猪淋巴结中的PCV2抗原;免疫组织化学,×200。(D)接种PCV2e的猪淋巴结中的PCV2抗原;免疫组织化学,×200。
在实验感染的猪中,PCV2的三种重要基因型(2a、2b和2d)和PCV2e的毒力存在统计学意义上的差异。根据血液和淋巴中的PCV2载量的测量水平,PCV2a、PCV2b和PCV2d的毒性比PCV2e更强。PCV2的三种重要基因型在毒力上没有显著差异,结论是目前的结果与韩国和美国之前的研究结果一致[5,21]。中国的一项研究得出的结论是PCV2d比PCV2a和PCV2b更具毒性,这一结果与这些研究的结果相互矛盾[11]。因此,不同国家分离到的PCV2的三种重要基因型的毒力存在差异。
在本研究中,猪在42日龄时被实验性感染PCV2,因为在韩国的猪场观察到,42~49日龄是这种病毒最常见的自然感染期(C. Chae,个人观察)。Cho等[5]对接种疫苗的猪进行了28 d的观察,而本研究将观察期缩短至21 d。与之前进行的评估PCV2与其他病原体共同感染的研究不同,仅实验性感染PCV2的猪临床上不会完全表现出PCVAD。在没有感染其他病原体的情况下,缩短观察期是合理的,因为这对临床体征和症状结果没有显著影响。
感染后PCV2e的复制能力明显下降。已经发表的研究报告评估了PCV2衣壳蛋白的细微变化如何在细胞水平上提高病毒的适应性水平,从而增加病毒对感染猪的毒力[7,17]。与感染PCV2的其他三种基因型的猪相比,感染PCV2e的猪血清中病毒载量较低,淋巴结中PCV2抗原阳性细胞较少。与PCV2a、PCV2b和PCV2d相比,PCV2e的病毒结构含有12或15个额外的ORF2序列核苷酸[6,13,18]。由于ORF2 3′端存在这些额外的核苷酸,PCV2e被认为是PCV2a、PCV2b和PCV2d的祖先[6]。这种独特的遗传特征可能会影响病毒在猪体内复制的效率,因而值得进一步研究。
本研究通过比较不同感染组和未感染组试验猪在PCV2基因组拷贝数或PCV2抗原阳性细胞数上的差异,确定了PCV2的毒力强度。这是一项重要的评估,因为PCV2的不同基因型在临床症状、抗体滴度和淋巴结组织学病变方面不存在统计学意义上的差异。实时PCR值在测试过程中也是可信赖的,是疾病流行病学测量唯一近似值之一[2]。PCV2感染在临床健康的猪中很常见,对阳性实时PCR检测结果的解释并不总是那么简单。
未来PCV2可能会出现新的基因型,因为该病毒是一种单链DNA病毒,其核苷酸置换率很高(与RNA病毒相当),这使基因组突变的可能性很高[8]。PCV2e是最近出现的基因型,多个国家都有报道[6,13,18,23]。血液和淋巴结中的PCV2载量上,接种PCV2a、PCV2b或PCV2d的猪明显高于接种PCV2e的猪。在实验研究中,所有同时感染猪肺炎支原体/PCV2e或PCV2e/PRRSV的猪都出现了轻度PCVAD,而单独感染PCV2e的猪则没有[20]。在流行病学调查中,流行率表明PCV2d是当前的显性基因型,而新出现的PCV2e在被评估的猪场中保持了最低的流行率[22]。需要进一步的研究来确定PCV2的这种新基因型的临床重要性。

 会员投稿
会员投稿 手机版
手机版 | 保健频道
| 保健频道















