郭镇洋 1t ,赵 静 1t ,付 军 1 ,许 浒 1 , 李 超 1 , 李宛生 1 , 孙 琪 1 , 裴艳艳 1,
龚帮俊 1 , 王 倩 1 , 周国辉 1 , 汤艳东 1 , 冷超粮 2 , 王永杰 3 , 陈长青 3 ,安同庆 1,
蔡雪辉 1 , 张洪亮 1* , 田志军 1* , 彭金美 1*
(1. 中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室, 黑龙江 哈尔滨 150069;
2. 南阳师范学院,河南 南阳 473061; 3. 河北省威远药业有限公司,河北 石家庄 052165)
摘 要: 为探究近几年猪伪狂犬病病毒(PRV)在我国的流行情况及遗传演化特征, 本研究对2016年~2021年 采自全国17个省、 市和自治区的2 299份临床样品经PCR检测, 并利用PCR扩增阳性样品中的PRV gB 、gE和gC基 因并测序, 采用MegAlign分析三者与GenBank登录的PRV参考株相应基因序列的同源性; 利用MEGA 7.0分别构建 上述3个基因的遗传进化树, 并采用MegAlign分析gB 、gE和gC蛋白氨基酸序列的差异, 分析其遗传演化及分子特 征的变化。 结果显示, 共扩增出24份PRV阳性样品, 阳性率约1.04%, 且不同年份及不同地区均有PRV的检出。 PRV gB 、gE和gC基因序列的同源性及遗传进化分析结果显示, 3个基因及其编码氨基酸序列均与2011年以来的 PRV变异株同源性最高, 且均属于基因Ⅱ型PRV变异株; 氨基酸序列比对结果显示, 与基因Ⅰ型PRV相比, 所测 PRV gB 、gE和gC中均存在特征性氨基酸突变位点: gB氨基酸序列aa75~a77连续缺失3个氨基酸(SPG) ,aa93~ aa94连续插入2个氨基酸(DG) ;gE氨基酸序列在aa48和aa496各插入1个氨基酸(D) ;gC氨基酸序列在aa63~aa69连 续插入7个氨基酸AAASTPA。 此外, 本研究通过比对国内外经典株以及2011年以来国内PRV gE蛋白的氨基酸序 列, 确定了不同亚型PRV (即指基因Ⅱ型PRV变异株和经典株)的分子特征即基因Ⅱ型PRV变异株: gE aa496为 “D+” 或aa496为 “D- ”+aa448 “I”; 基因Ⅱ型PRV经典株: gE为aa496 “D- ”+aa448 “V/A”。 上述结果表明, 我国 现阶段仍以基因Ⅱ型PRV变异株的流行为主, 进一步明确了不同基因型和亚型PRV的分子特征, 对了解我国PRV 的流行现状及当前流行株的分子特征具有重要意义, 为PRV诊断试剂的研发及PR的防控提供了参考。
关键词: 猪伪狂犬病病毒; 变异株; 遗传演化; 分子特征
中图分类号: S852.65 文献标识码: A 文章编号: 1008-0589(2023)02-0122-07
Abstract: PRV variant was emerged and spread in China causing severe impacts on the pig industry in 2011. In order to know the characteristics of PRV in the prevalence and genetic evolution in China in recent years, 2299 clinical samples collected from 17 provinces from 2016 to 2021 were tested with PCR. The gB, gE and gC genes in PRV positive samples were amplified by PCRs and the resulting amplicons were sequenced. The homology analysis was performed with MegAlign software for these three obtained sequences against their corresponding sequences available in NCBI database. The genetic evolution tree of the three genes was constructed by using MEGA7.0 software, and the differences of amino acid sequences for gB, gE and gC proteins were ananlyzed with MagAlign for studying their genetic evolution and molecular characteristics. The results showed that a total of 24 PRV positive samples were amplified, with a positive rate of 1.04% . PRV was detected in different years and different regions. The results of homology and genetic evolution analysis of PRV gB, gE and gC sequences showed that the three genes and their encoded amino acid sequences shared the highest homology with PRV variants available since 2011, and all of them belonged to genotype Ⅱ PRV variants. The results of amino acid sequences alignment showed that compared with genotype I PRV, there were characteristic amino acid mutation sites within the gB, gE and gC proteins of the tested PRV: gB protein had 3-amino-acids (SPG) deletion at aa75-aa77 and 2-amino-acids (DG) insertion at aa93-aa94; gE protein had one-amino-acid (D) insertion at aa48 and aa496, respectively; gC protein had 7-amino-acids (AAASTPA) insertion at position aa63-aa69. In addition, the molecular characteristics of different PRV subtypes (refers to genotype II PRV variant and classic strains) were identified by comparing the amino acid sequences of gE proteins of classical strains as well as those of domestic PRV strains since 2011. Variants of PRV of genotypeⅡ: the gE encoded amino acid sequences had "D+" in the position of aa496 or "D-" in aa496+"I" in aa448; Classic strains of PRV of genotype Ⅱ : the gE encoded amino acid sequences had "D-" in the position of aa496+"V/A" in aa448. These results indicate that PRV variants of genotype II are still prevalent in China at present, and the molecular characteristics of different genotypes and subtypes (variant and classical strains) of PRV are clarified further, which are of great significance for understanding the epidemic status of PRV and molecular characteristics of current circulating strains in China, and provide reference for the development of PRV diagnostic reagents and the prevention and control of PR in pig farms.
Key words: porcine pseudorabies virus; variants; phylogenetic analysis; molecular characteristics
猪伪狂犬病(Porcine pseudorabies,PR),又称奥耶兹基氏病,是由PR病毒(PRV)引起的家畜和野生动物的一种烈性传染病。猪是该病原的自然宿主,其主要威胁妊娠母猪和新生仔猪,临床表现为妊娠 母猪流产、产死胎、木乃伊胎;新生仔猪神经症状,病死率达100%,给养猪业造成重大经济损失。
1813年首次于牛群中报道该病[1] ,并于20世纪 40年代开始在欧洲猪场流行,20世纪60年代美国部 分地区报道了强毒力PRV[2-3] ,同一 时期在我国也报 道了PRV强毒株[4]。20世纪80年代开始随着我国集 约化养殖的兴起,PR的报道也越来越多,该时期我 国流行的PRV主要为经典株,包括Ea、 Fa、 SC株 等 。欧 美 一 些 国 家 通 过 免 疫 基 因 缺 失 疫 苗 (Bartha-K61株等)并配合相应的鉴别诊断方法完成了 该 病 原 的 净 化 [5] ,70 年 代 末 我 国 从 匈 牙 利 引 入Bartha-K61疫苗株,有效地控制了PR在我国的大规模流行。2011年底,我国多个免疫过Bartha-K61株疫 苗的猪场再次暴发PR,研究发现,新流行株为PRV 变异株(代表株为HeN1、TJ、HLJ8等),致病力增 强,且Bartha-K61疫苗仅对免疫猪提供部分抵抗PRV 变异株攻击的能力[6-7]。2017年以来,中国陆续出现 人感染PRV的病例[8-9] ,并首次分离出与PRV变异株 有密切亲缘关系的人源PRV(hSD- 1/2019株)[10]。 这表 明,现阶段我国流行的PRV变异株具有感染人类的 潜力,其对公共卫生安全的潜在威胁不容小觑。
在PRV编码的11个糖蛋白中, gB和gC是诱导机 体产生中和抗体的主要糖蛋白,其中gB作为疱疹病 毒中最保守的囊膜蛋白,在病毒侵入宿主及在细胞 间的传播中起重要作用[11] ;gC蛋白能与宿主表面受 体结合介导病毒的侵入,诱导机体产生体液免疫和细胞免疫反应[12] ;此外,US8作为PRV主要的毒力基因,其编码的gE蛋白可以辅助细胞融合和协助病毒在细胞之间传播[13]。已有研究显示,gE蛋白aa48和aa496各插入一个天冬氨酸(D),可以作为变异株分子检测的靶标[14] ;gC蛋白在aa63~aa69连续插入7个氨基酸(AAASTPA),可以作为鉴定基因Ⅰ型与基因Ⅱ型PRV的分子特征[15] ,但基因Ⅱ型PRV的两种 亚型,即变异株和经典株相应蛋白的分子特征尚不明确。基于此,本研究对2016年~2021年我国部分地区开展PRV的流行病学调查,分析我国PRV的主要基因型及亚型,经PCR扩增流行PRV的gB、gE和 gC基因序列并测序,分析上述基因序列的同源性及遗传演化特征,探究PRV的流行特点及其分子特征,为猪场PR的防控提供参考依据。
1 材料与方法
1 . 1 主 要 试 剂 TIANamp Genomic DNA Kit 购 自 TIANGEN 公 司 ;Gel Extraction Kit 购 自 OMEGA 公 司 ; GC Buffer、 LA Taq DNA 聚 合 酶 、dNTPs、pMD18-T载体等均购自TaKaRa公司; 大肠杆菌TG1 感受态细胞由本实验室制备。
1 .2 临床样品的采集与处理 2016年~2021年于全 国17个省、 市和自治区(黑龙江省、内蒙古自治区、吉林省、辽宁省、新疆维吾尔自治区、天津市、河北省、山西省、 山东省、 河南省、 湖北省、 江西 省、 安徽省、 四川省、 浙江省、 江苏省、 广东省)共 收集2 299份病料样品, 包括发病猪的肺、 淋巴结、 脑、脾、 扁桃体等组织。 取0 .5 g病料样品加入1 mL DMEM研磨匀浆, 取200 μL利用TIANamp Genomic DNA Kit提取总DNA, 剩余样品在-80 ℃保存备用。
1 .3 引物设计 参照GenBank中登录的PRV HeN1 (KP098534 . 1)、 TJ (KJ789182 . 1)、 Ea (KU315430 . 1)、 Fa (KM189913 . 1)、 Bartha (JF797217 . 1)、 Kaplan (KJ717942 . 1)株的基因序列设计gB基因的扩增引物 (F: GTGCTGGCCTCGGACGTCT/R: GTTGTAGCG CCGCCGGTAGAT); 参照文献[7, 15]设计gE扩增引 物 (F: ATGCGGCCCTTTCTG/R: CGGTTCTCCCGG TATTTAAGC) 和 gC (F: GACCGTCGCCATGTGTGC CACTAGC/R:ACGCGCGAGAGCCCACACACACAC G)基因的扩增引物,以上引物均由北京睿博兴科生 物技术有限公司合成。
1 .4 临床样品的PRV检测及流行病学分析 以1 . 1 采集的17个省、 市和自治区共2 299份病料样品的 DNA为模板, 采用上述特异性引物, 经PCR分别扩 增其中PRV的gB、 gE和gC基因编码区序列, 扩增程 序为 , 95 ℃ 5 min; 94 ℃ 30 s、 53 ℃ /58 ℃ /63 ℃ 30 s、 72 ℃ 2 min 30 s, 共30个循环; 72 ℃ 10 min。 PCR产物经1%的琼脂糖凝胶电泳检测。 只要任一基 因扩增为阳性即认为该样品为PRV阳性样品。 根据 检测结果分析该病原在我国各地的流行特点。
1 .5 PRV阳性样品gB 、gE和gC基因的PCR扩增及 测序 采用gB、 gE和gC特异性引物, 以提取的PRV 阳性样品DNA为模板,经PCR扩增,扩增程序同1 .4。 PCR产物经纯化回收后分别克隆至pMD18-T载体中, 构建的重组质粒均由北京睿博兴生物有限公司测序。
1 .6 PRV gB 、gE和gC序列的同源性和遗传演化分 析 选取NCBI中登录的PRV相应基因序列, 包括 PRV国外株、 国内早期经典株以及2011年以来国内 PRV的gB基因序列100条、 gE基因序列213条、 gC基 因序列133条。 利用生物学软件MegAlign分别分析 gB、 gE和gC基因及其编码氨基酸序列的同源性, 利 用MEGA 7 .0 (设置: NJ-method, K2 modal and boot- strap=1000)构建gB、 gE和gC基因的遗传进化树。
1 .7 PRV gB 、 gE 和gC 氨基酸序列的分析 利用 MegAlign软件分析所测的gB、 gE和gC氨基酸序列的 差异, 将上述氨基酸序列与1 .6中检索的PRV相应基 因序列编码的氨基酸序列比对, 分析不同基因型和 亚型PRV gB、 gE和gC之间氨基酸序列的差异。
2 结 果
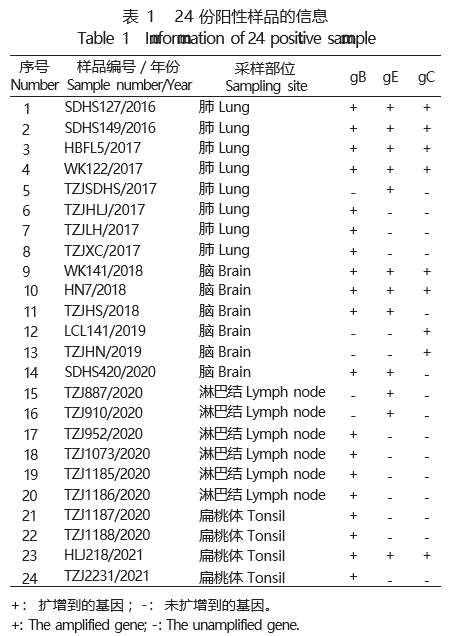
2 . 1 临床样品的PRV 检测及PRV 阳性样品基因的 PCR扩增结果 采用PCR对2016年~2021年采集的 2 299份临床样品中PRV的gB、 gE和gC基因分别经 PCR扩增, 结果显示, 共检出PRV阳性样品24份(主 要来源于发病猪的肺8份、 脑6份、 淋巴结6份、 扁 桃 体 4 份 ), 阳 性 率 约 为 1 .04% , 其 中 2016 年 2 份 (2/192)、 2017 年 6 份 (6/215)、 2018 年 3 份 (3/392)、 2019 年 2 份 (2/347)、 2020 年 9 份 (9/470)、 2021 年 2 份 (2/683)。 在区域分布上为: 山东6份、 河北6份、 黑 龙江5份、 河南4份、 陕西1份、 辽宁1份、 内蒙古1 份(表1)。 以24份PRV阳性样品的DNA为模板, 分别 扩增出gB基因序列19条、 gE基因序列12条、 gC基因序列9条。 部分样品未扩增出相应基因, 具体原因 的分析详见讨论。 上述结果表明, 山东、 河北、 黑 龙江、 河南的PRV检出率较高, 且以2020年的检出 率最高。
2 .2 PRV gB 、gE和gC序列同源性和遗传演化分析 gB序列同源性分析显示, 19条gB基因与氨基酸序列 之 间 的 相 似 性 分 别 为 98 .9% ~99 .3% 、 98 .2% ~ 99 .3%, 与基因Ⅰ型PRV、基因Ⅱ型PRV经典株、 基 因Ⅱ型PRV变异株gB基因/氨基酸序列的相似性分别 为 96 .8% ~97 .4% /94 .4% ~96 .9% 、 99 .0% ~99 .3% / 98 .2%~99 . 1%、 99 . 1% ~99 .3%/98 .7% ~99 .3%。 gB 基因的遗传演化分析结果显示, PRV分为2种基因型 (Genotype Ⅰ、 Genotype Ⅱ ), 我国流行的主要为基 因Ⅱ型PRV。 本研究所测的19条gB基因序列均处于 同一分支, 属于基因Ⅱ型, 与变异株(HeN1、 TJ等) 处于同一分支且亲缘关系较近(图1A)。

gE序列的同源性分析结果显示, 12条gE基因/氨 基酸序列的相似性分别为 99 .2% ~99 .7% /98 .0%~ 99 .2%, 与基因Ⅰ型PRV、基因Ⅱ型PRV经典株、 基 因Ⅱ型PRV变异株gE基因/氨基酸序列的相似性分别 为 93 .6% ~94 .7% /90 .2% ~92 .6% 、 94 .6% ~99 .6% /92 .2% ~99 .0%、 99 .4% ~99 .9%/98 .2% ~99 .6%。 gE 基因的遗传演化分析结果显示, 12株PRV均属于基 因Ⅱ型, 与国内早期PRV经典株(Fa、 Ea、 SC株)亲 缘关系相对较远, 与2011年以来的变异株(HeN1、 HLJ8等)处于同 一分支且亲缘关系较近(图1B)。此外,相对于gB和gC基因, gE基因的分支较多, 遗传 演化关系更复杂(图1B)。
gC序列的同源性分析显示, 所测9株PRV gC基 因/氨基酸序列的相似性分别为99.4%~99.9%/98.6%~ 99 .7%, 与基因Ⅰ型PRV、基因Ⅱ型PRV经典株、 基 因Ⅱ型PRV变异株gC基因/氨基酸序列的相似性分别 为 97 . 1% ~97 .5% /94 .6% ~95 .7% 、 99 .3% ~99 .5% / 98 .3%~99 .0%、 99 .4% ~99 .9%/98 .8% ~99 .8%。 gC 基因的遗传演化分析结果显示, 本研究所测的9株 均属于基因Ⅱ型PRV, 与国内早期PRV经典株(Fa、 Ea株)亲缘关系相对较远, 与2011年以来的变异株 (HeN1、 TJ等)处于同一分支且亲缘关系较近(图1C)。 上述结果表明, 本研究所测的PRV属于基因Ⅱ型变 异株。
2 .3 PRV gB 、gE 和gC 氨基酸序列比对分析 gB 氨基酸序列比对结果显示, 与基因Ⅰ型PRV(Kolchis、 Kaplan、 Bartha等)相比, 19条gB氨基酸序列以及所 有基因Ⅱ型PRV gB氨基酸序列在aa93~aa94均连续插 入2个氨基酸(DG), 除了GDFS01株外, 所有基因Ⅰ 型PRV gB氨基酸序列在该位点均有相同缺失; 在 aa75 ~aa77连续缺失3个氨基酸(SPG), 虽然部分基 因Ⅰ型PRV (NIA3、 Becker株等) gB氨基酸序列在该 位点也有相同的缺失, 但所有基因Ⅱ型PRV在该位 点的缺失均 一 致(表2)。 此外, 与基因Ⅰ型PRV相 比, 基因Ⅱ型PRV gB氨基酸序列还存在5个氨基酸 的特异性突变(表2)。 gB是病毒感染必需的囊膜蛋 白, 能够诱导机体产生中和抗体, 其个别氨基酸的 突变可能造成其免疫原性的改变, 这在一定程度上 解释了Bartha-K61株仅对免疫猪提供部分抵抗PRV变 异株攻击能力的原因[16]。 值得注意地是, 与2011年 以来的国内PRV变异株(HeN1、 JS-2012等)相比, 本 研究所测序的gB氨基酸序列均无特异性变化。
gE氨基酸序列比对结果显示, 12条gE氨基酸序 列与变异株相比均无特异性变化; 变异株与大部分 经典株在aa48插入1个D; 大部分变异株在aa496插入 一个D,个别变异株则在aa496缺失D及aa448为I; 经 典株则在aa496缺失D且aa448为V/A (图2)。 除此之外, 与基因Ⅰ型PRV相比, 基因Ⅱ型PRV gE存在9 个氨基酸的特异性突变(表3)。
gC氨基酸序列比对结果显示, 9条gC氨基酸序 列与变异株相比无特异性突变; 与基因Ⅰ型PRV相 比, 基因Ⅱ型PRV gC氨基酸序列在aa63~aa69均存 在7个氨基酸的连续插入(AAASTPA)及12个氨基酸 的特异性突变(表4)。
上述结果表明, 与基因Ⅰ型PRV相比, 本研究 所测的gB、 gE和gC氨基酸序列存在较多特异性氨基 酸突变, 与经典株相比则存在个别位点的氨基酸突 变, 与变异株相比基本无特异性突变。
![]()


3 讨 论
作为一种潜在的人兽共患病, PRV对养殖业以及人类公共卫生安全的潜在威胁不容忽视。 据报 道, 减毒PRV也可引起猫的轻微临床症状, 并且在 感染第3 d开始排毒[17]。猫作为常见的伴侣动物, 使 得人感染PRV的机会增加, 尽管之前的报道称, 人 感染PRV仅为一种职业风险[18] ,但随着第一例人源 PRV (hSD- 1/2019株)的分离[10] ,对该病原的认识随即 上升到新的高度。 到目前为止, 其他动物(牛、 山 羊、 兔子等)感染PRV也时有发生[19] ,但猪作为PRV 的自然宿主,感染后造成的经济损失更严重。
本研究对2016年~2021年采集的2 299份临床样 品的检测结果显示, 共检出PRV阳性样品24份, 阳 性率约为1 .04%。 其中2020年检出9份, 占比最多, 这可能与非洲猪瘟后猪场引入PRV阳性母猪有关[20]。 24份阳性样品中有部分样品仅扩增出gB或gE或gC基 因, 这可能与基因自身特性(如基因的结构、 某些基 因不易扩增)以及样品中的病毒载量过低有关, 具体 原因有待进一步探究。 此外, 与近几年报道的PRV 流行病学调查结果相比(孙颖等在2018年对我国28个 省、 市、 自治区的1 328份疑似患PR猪的组织样品的 检测结果显示, 检出PRV阳性病料样品92份, 阳性 检出率为6 .93%; 姚军等在2017年~2021年对我国 云南省猪场开展了PRV的血清学和流行病学调查, 其中在416份疑似PR病猪的组织样品中检出PRV阳 性样品43份, 阳性检出率为10 .33%[16,21] ,本研究采 集样品的PRV平均阳性检出率较低, 可能与采样的 时间、 区域、 范围、 密集度有关。 此外, PRV阳性 检出率较低的主要原因可能还与非洲猪瘟疫情导致 中国猪场的生物安全管理升级和PRV疫苗免疫覆盖 面增加有关。 但本研究的PRV阳性检出率与近期相 关研究机构公布的PRV流行病学调查报告结果基本相符, 说明近几年我国PR的防控取得了 一 定的成 效。 病原检测的意义更多体现在对病原生物学特性 及其基因的鉴定, 明确流行株的基因型, 指导现地 采取针对性的防控措施, 但如果在病毒感染初期检 测, 则易漏检, 而检测gE抗体更能反映猪PRV的实 际感染状况, 因此PRV和其gE抗体的检测对PR防控 的指导作用不同, 将二者的检测结果结合分析更有 意义[22]。 总之, 较低的阳性检出率并不代表PRV的 感染风险也低, 若因此降低监测和防控力度可能会 致PR的再度暴发。 因此, 应该强制免疫, 加强监 测, 及时淘汰野毒感染动物, 从区域净化逐步做到 全国净化。
基于gB、 gE和gC基因及氨基酸序列的同源性分 析显示, 24株PRV与变异株的相似性最高, 经典株 次之,基因Ⅰ型最低;基于gB、 gE和gC基因的遗传 演化分析显示, 24株PRV均属于基因Ⅱ型且与国内 早期经典株亲缘关系较远。 表明, 2016年以来我国 PRV仍以变异株的流行为主。 多项研究结果表明当 前的商品化疫苗(Bartha-K61株)仅对免疫猪提供部分 抵抗PRV变异株攻击的能力[6-7]。 目前, 国内研发的 PRV疫苗主要是以早期经典株为亲本株的基因缺失 苗, 如基于牛源性Fa株研发的SA215株和基于Ea株 研发的HB-98株等[23-24]。 面对PRV变异株的流行, 这 些基于国内经典株为亲本株所研制疫苗的保护效果 还需进 一 步探究 [25] , 因此, 研究人员还开发了以 PRV变异株(HeN1)为亲本株的5基因缺失疫苗TP株 (同时缺失gE、 gI、 TK、US9、US2), 该疫苗能够对 猪提供完全的免疫保护效果, 是较为理想的抵抗 PRV变异株的候选基因缺失疫苗[26]。
此外, 本研究通过比对国内外经典株以及2011 年~2021年以来的PRV gB、 gE和gC的氨基酸序列, 阐明了不同基因型及亚型PRV的分子特征即基因Ⅰ 型PRV:gC氨基酸序列aa63~aa69为“(AAASTPA)+”; 基 因 Ⅱ 型 PRV: gC 氨 基 酸 序 列 aa63 ~aa69 为 “(AAASTPA)- ”;基因Ⅱ型PRV变异株: gE氨基酸序 列aa496为D+ 或aa496为D-+aa448为I; 基因Ⅱ型PRV 经典株: gE氨基酸序列aa496为D-+aa448为V/A。 另 外, 3个蛋白氨基酸序列的其余特异性氨基酸突变 也可为PRV的分型提供参考, 但由于这些突变分布 较分散且种类较多,且gB、 gE和gC特征性氨基酸的 突变已经在相关研究中报道[14-15] , 因此本研究仅展 示了能够区分变异株与经典株的gE氨基酸序列比对图,而将其它蛋白的氨基酸突变展示于表格中。 综 上所述, 现阶段我国PRV主要以基因Ⅱ型变异株的 流行为主, 同时, 本研究明确了不同基因型及亚型 PRV的分子特征, 解决了以往经典株与变异株区分 模糊的问题, 为PRV的分类及PR的防控提供了参考 及指导。
 会员投稿
会员投稿 手机版
手机版 | 调查频道
| 调查频道














